活细胞成像观察的有力工具
特殊的光路设计,密封的体系使Etaluma无需外配培养装置,而直接放置在常规二氧化碳培养箱、三气培养箱、厌氧箱、4℃冰箱、超净工作台等,对各类动植物、微生物的活细胞或组织直接观察成像,稳定的培养环境可保持活体样本连续采集长达数月;可实现真正的2D/3D活细胞样本高通量实时观察。
开放性平台
平台开放式设计,灵活稳定的操作平台可以搭载显微注射仪,单细胞采集系统,膜片钳等进行多重应用组合,实现自动化监控与显微注射,单细胞捕获等同时操作。


兼容常规样品容器
兼容常规6-384孔板、载玻片、35mm培养皿、50mm培养皿、100mm培养皿、T-25或T-75培养瓶、微流控芯片等。
多种物镜规格可选
无限远校正、RWS螺纹、活细胞专用的长工作距离物镜;1.25×-100×物镜可选,明场、相差物镜可选,既可以观察群体细胞,又可对亚细胞结构进一步观察。
成像模式
动态影像
Etaluma可以同时对1536个样本自动的采集,每个样本的时间连续图像可以自动合成动态视频;且整个采集过程细胞样本不离开原有培养环境,在强大的聚焦模块下可以手动或自动拍摄短则几分钟,长则几个月的活细胞样本。
定点录像
钙离子流,细胞消化等实验实现快速摄像功能,以30桢/秒的成像速度实时捕捉样本的快速动态变化过程。
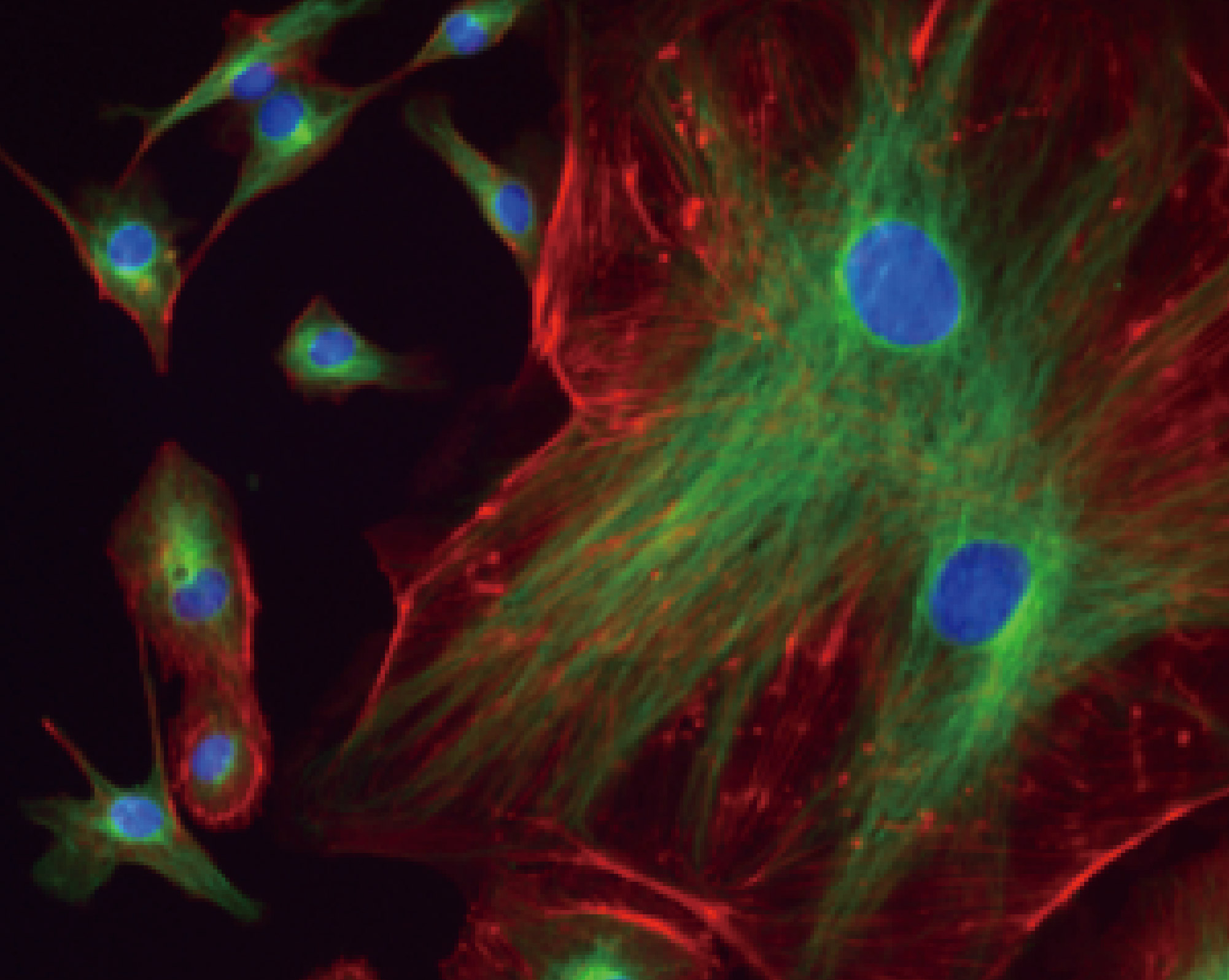
荧光成像
Etaluma具有固态光学设计,光路长度3英寸,是常规光路长度的1/10,可实现高效弱荧光成像及荧光标记样本的长时间低漂白检测;红绿蓝三色荧光通道,满足多种荧光样本需求。
明场,相差成像
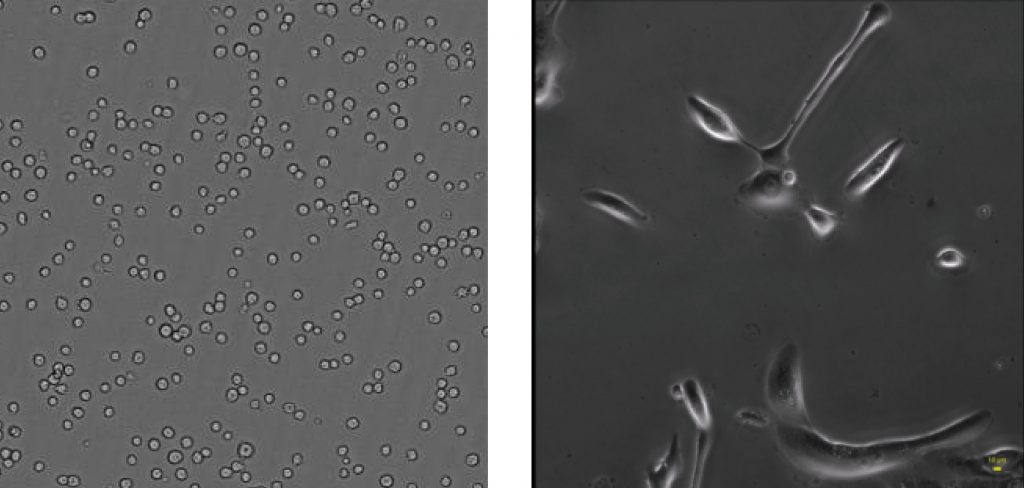
Etaluma通过实时无标记成像,明场或相差模式有效提高图像对比度,区分细胞内结构微小差异,实现样品无标记状态。
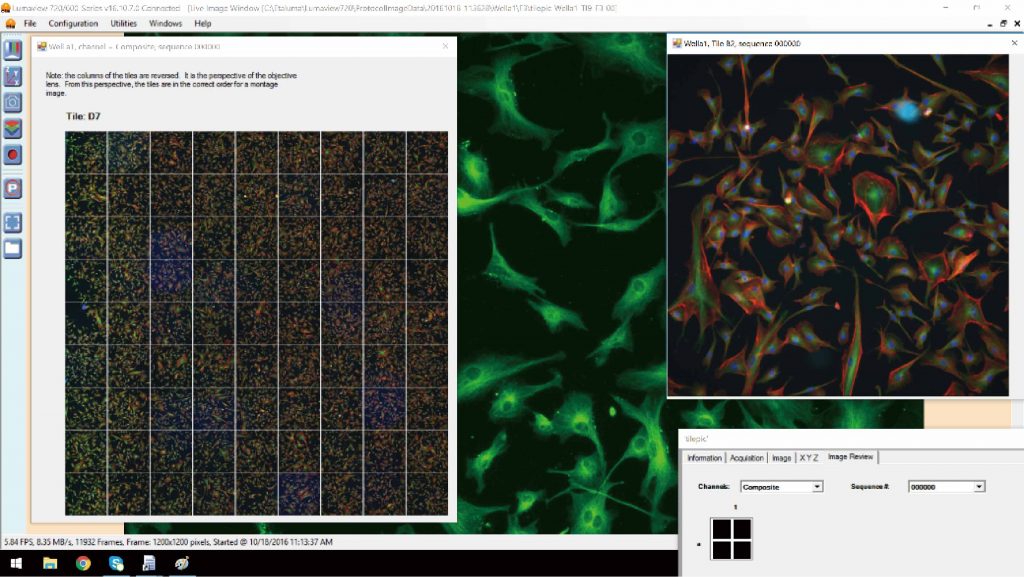
拼接成像
可将采集好的多幅图像自动拼接成完整的大幅图像,适合组织切片,干细胞,单克隆等样本的成像。
Z-stack成像
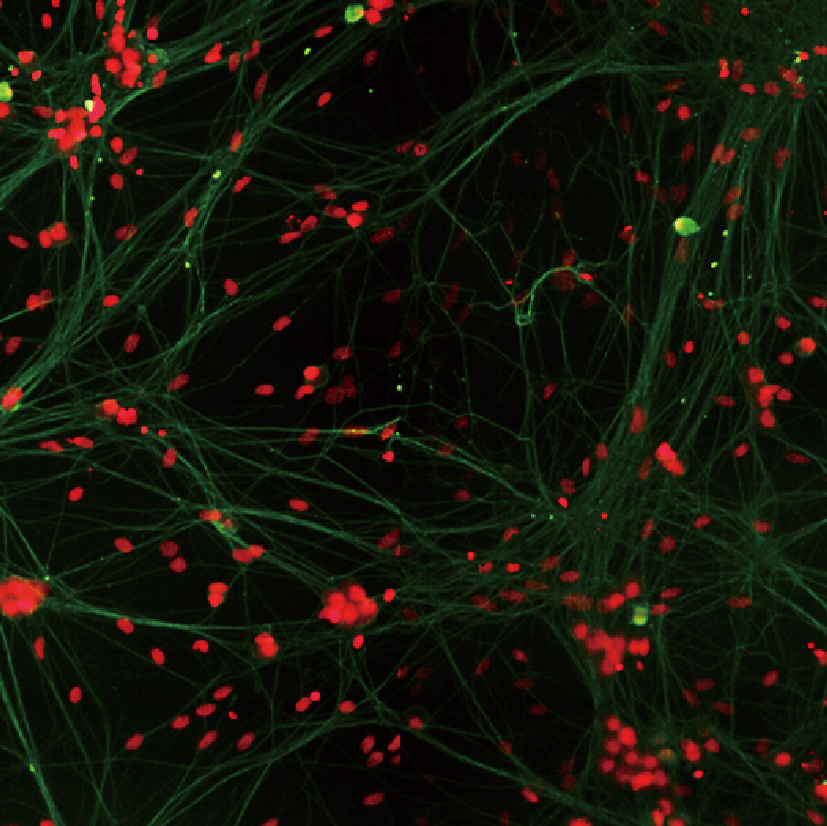
成像系统可以对不同聚焦平面进行Z-stack扫描,最大覆盖范围可达12000um;不仅可以拍摄到同一视野下不同层面的图像,还能从每张图像中提取聚焦效果像素图片,生成Z-max图像和三维重构图像。适合厚组织样本,神经元及神经网络。
实验方向
肿瘤学研究:
细胞毒性实验
细胞健康
细胞迁移/趋化运动
线粒体损伤
Transwell侵袭实验
DNA合成
报告基因检测
细胞凋亡/焦亡检测
细胞周期
细胞自噬
单细胞追踪
神经生物学研究:
神经突触生长、共培养
间充质干细胞定向诱导神经元
三维组织培养
3D肿瘤组织观察:
校准株3D培养
发育生物学:
受精卵发育
卵母细胞减数分裂
斑马鱼观察
免疫学研究:
T\NK细胞免疫杀伤评估
中性粒细胞吞噬、共定位
疟原虫侵染癌细胞
心脑血管研究:
心肌细胞搏动频率
钙流检测
iPSC-CM模型
芯片内血栓形成
血脑屏障
血液细胞在内皮细胞层粘附
膜片钳心肌电生理监测
干细胞研究:
IPSC细胞系生产
定向诱导、单克隆筛选
干细胞特异性标记
胚胎小体形态
生物材料:
纳米生物、3D打印等
活体动物:
组织活检、线虫、斑马鱼、转基因肿瘤小鼠
固定细胞/组织的终点分析
病理切片等
微生物:
单菌或菌落的抑菌机制、生物膜形成、噬癍实验、肠道微生物互作、酵母代谢等
植物:浦肯野纤维等
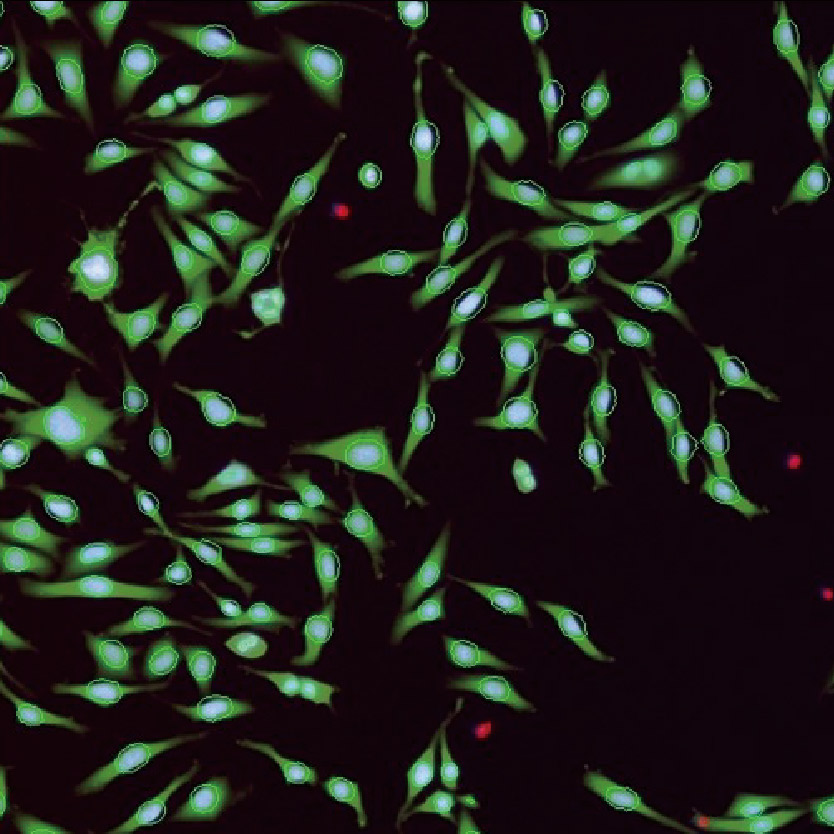
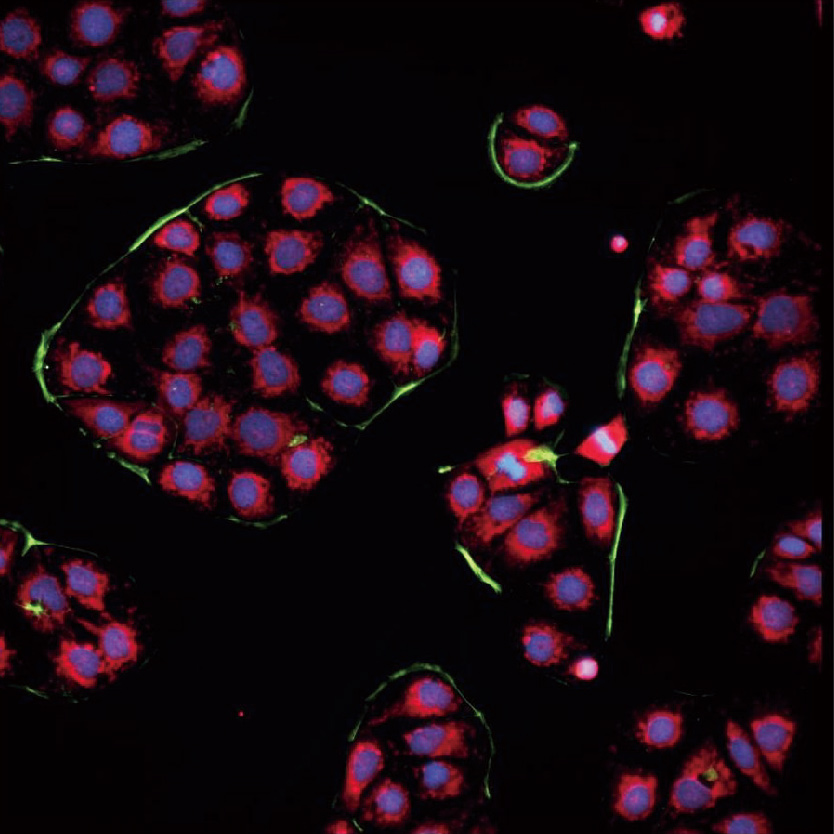
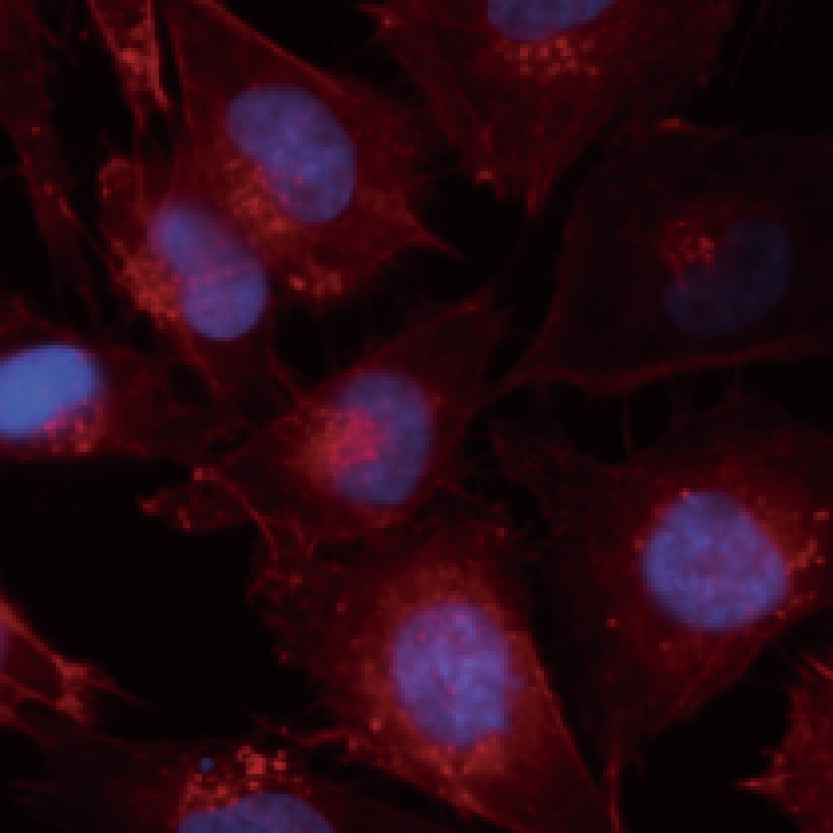
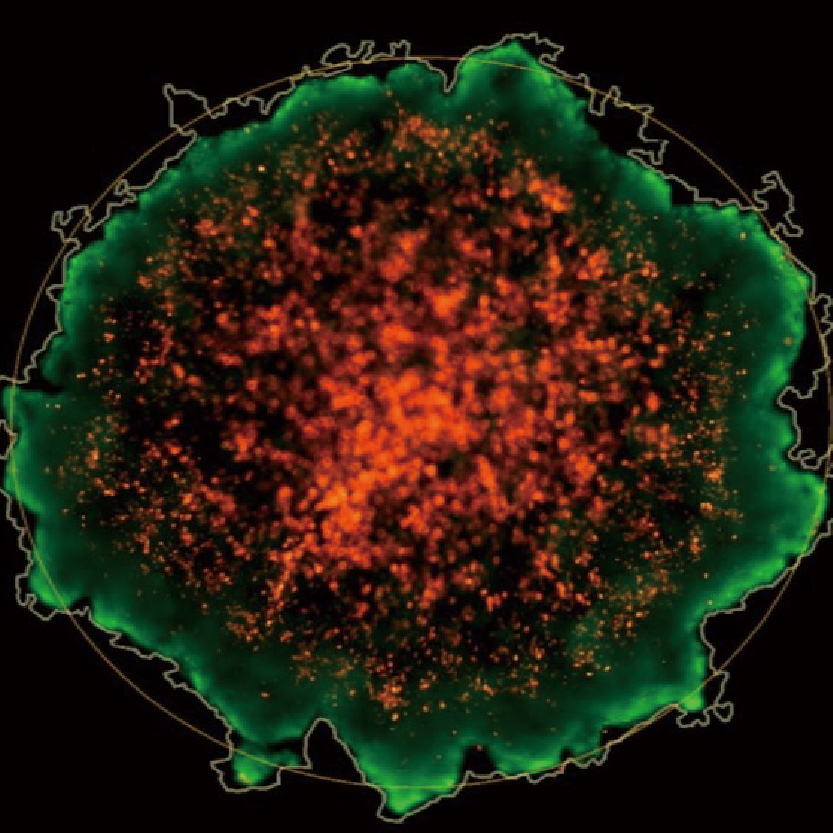

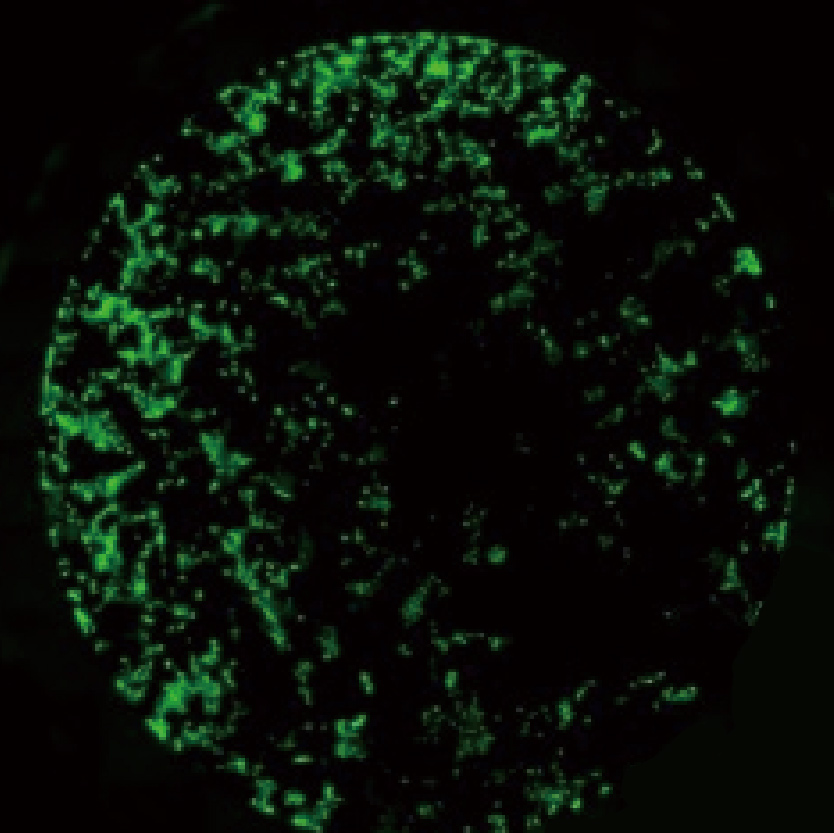


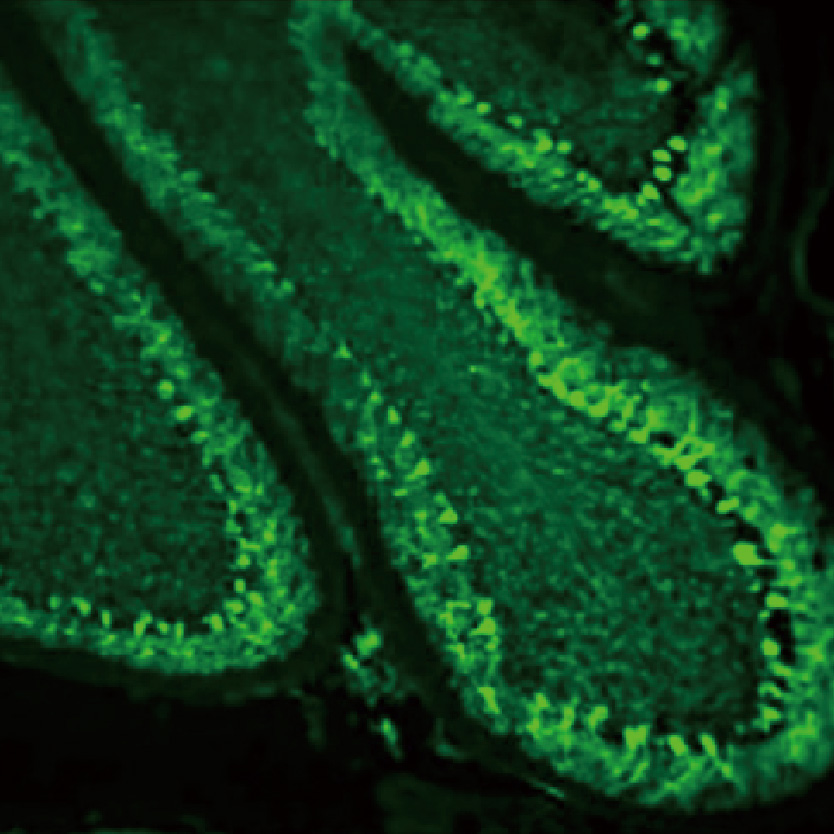
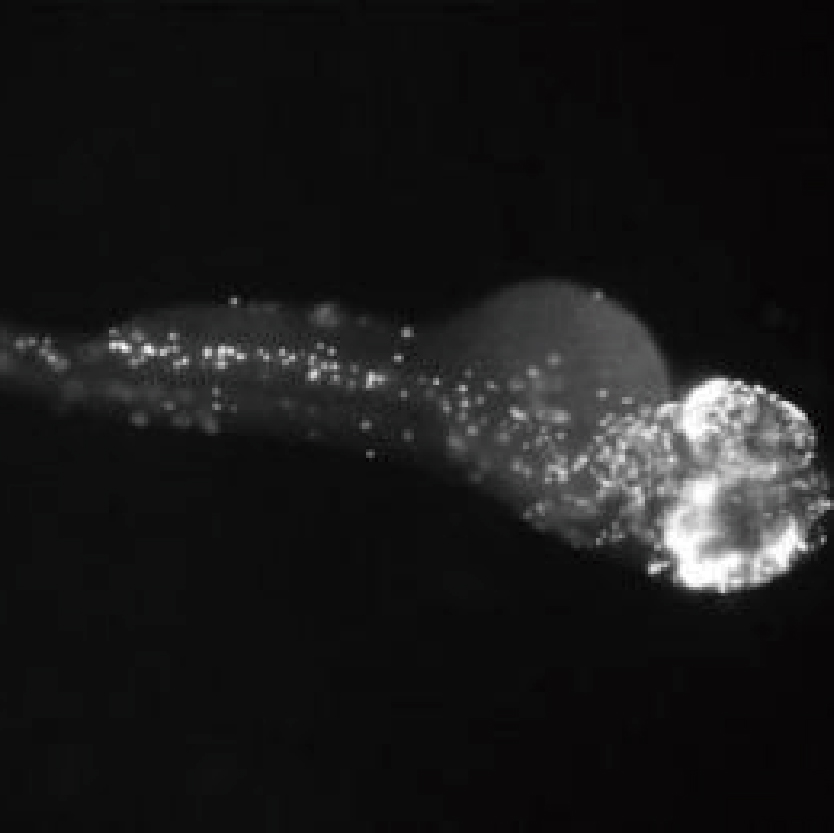


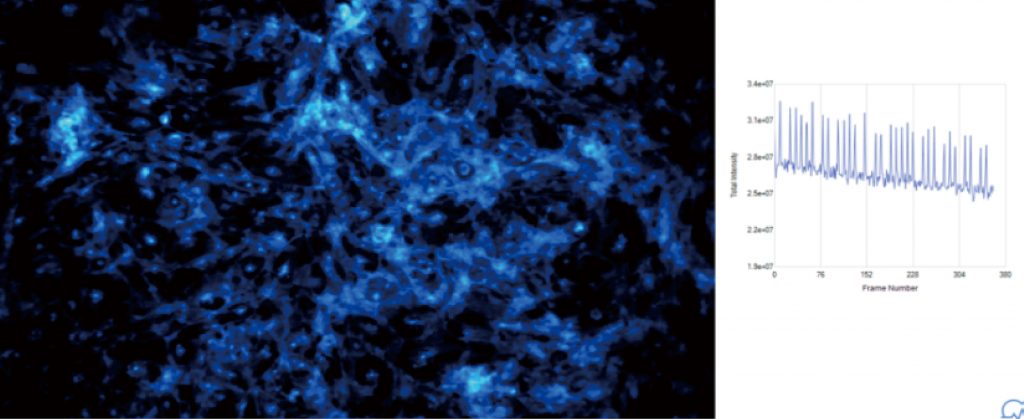
Lumaquant图像分析软件
专业分析软件内置多种应用,包含细胞增殖模块,细胞凋亡模块,细胞迁移模块,细胞追踪模块,核追踪模块,细胞转染模块,神经轴突生长模块,颗粒追踪模块,单克隆分析模块,心肌/钙离子流模块等,简单快速获取数据:批量编辑图片、视频,一键导出保存;批量处理实验文件,自动对单细胞及群体细胞进行定量统计,提供形态学和行为学参数,包括数量,圆度,面积,周长,荧光强度,速度,加速度等,数据可一键导出。
自动细胞计数与曲线拟合
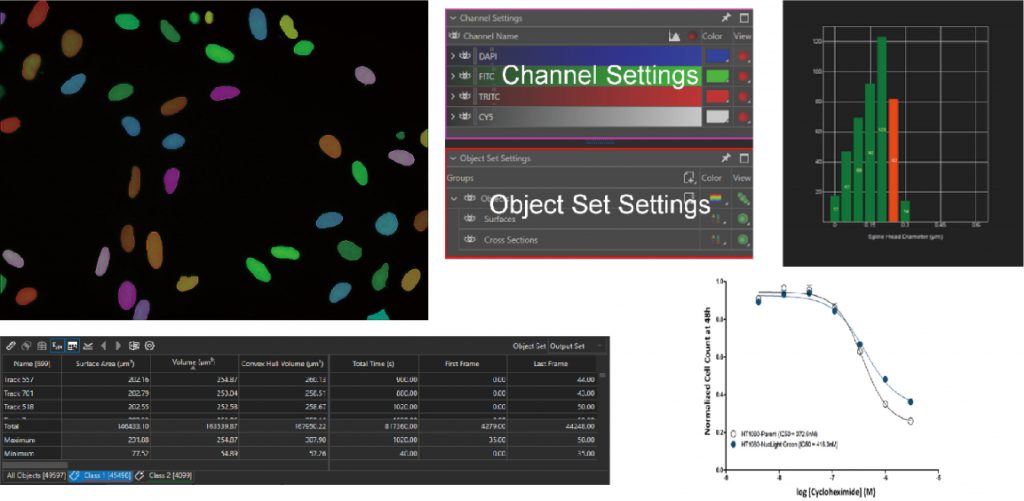
AI智能学习
可以设计分析软件流程方案以便快捷的区分目标对象及背景。Pixel classifier功能提供传统图像分析软件无法实现的样品识别和检测方法。
细胞亚群分析
软件具有强大的分割和计算能力,通过荧光标记物检测,可实时定量检测细胞亚群的变化。

实用案例
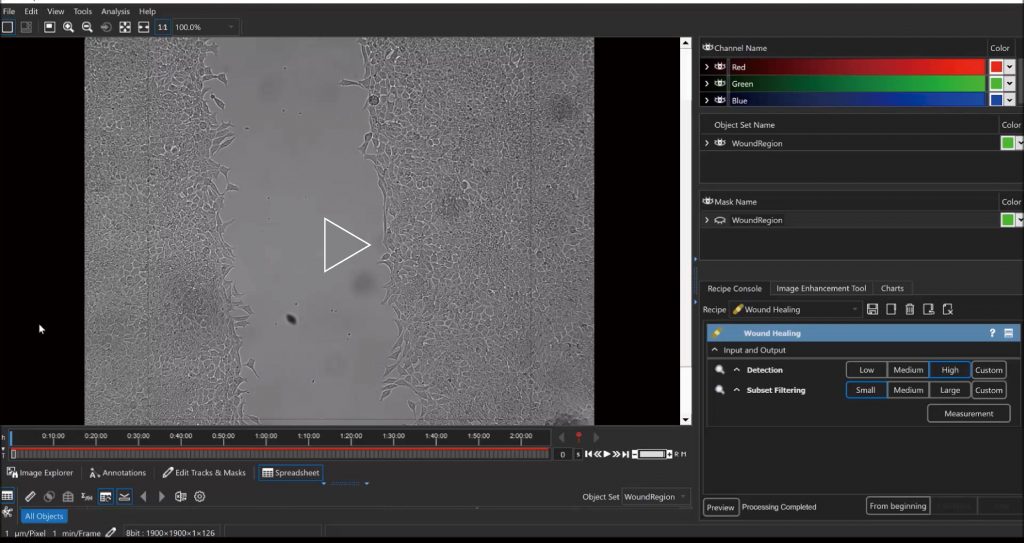
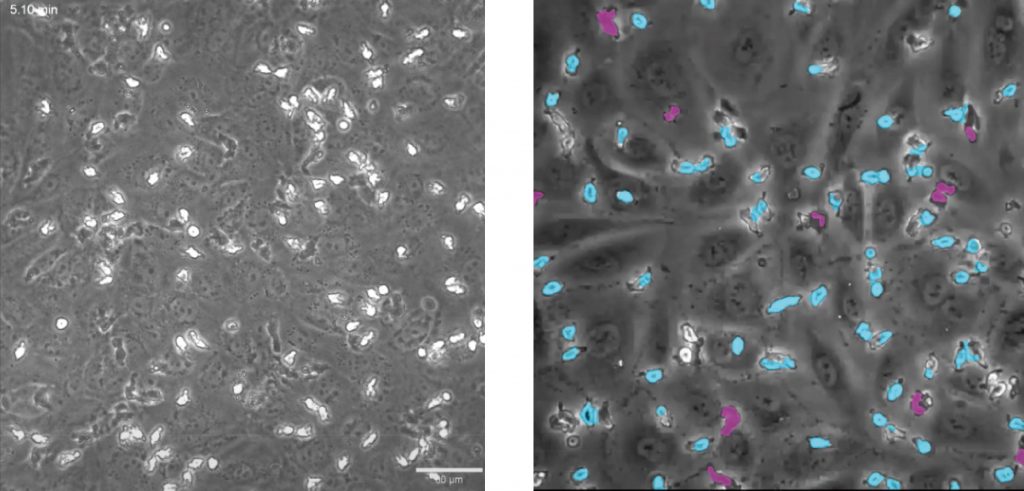
细胞迁移/侵袭/趋化运动——transwell
细胞迁移、细胞侵袭、趋化运动是免疫反应、肿瘤转移、伤口愈合和血管形成等过程的主要组成步骤。LS720可对各种原代细胞系和长生细胞系进行非标记的细胞迁移、趋化运动的定量测定;自动定量测量伤口饱和度,划痕宽度, 伤口闭合速度、迁移细胞数量等多种参数;并辅以图像和时序录像验证药理学作用。
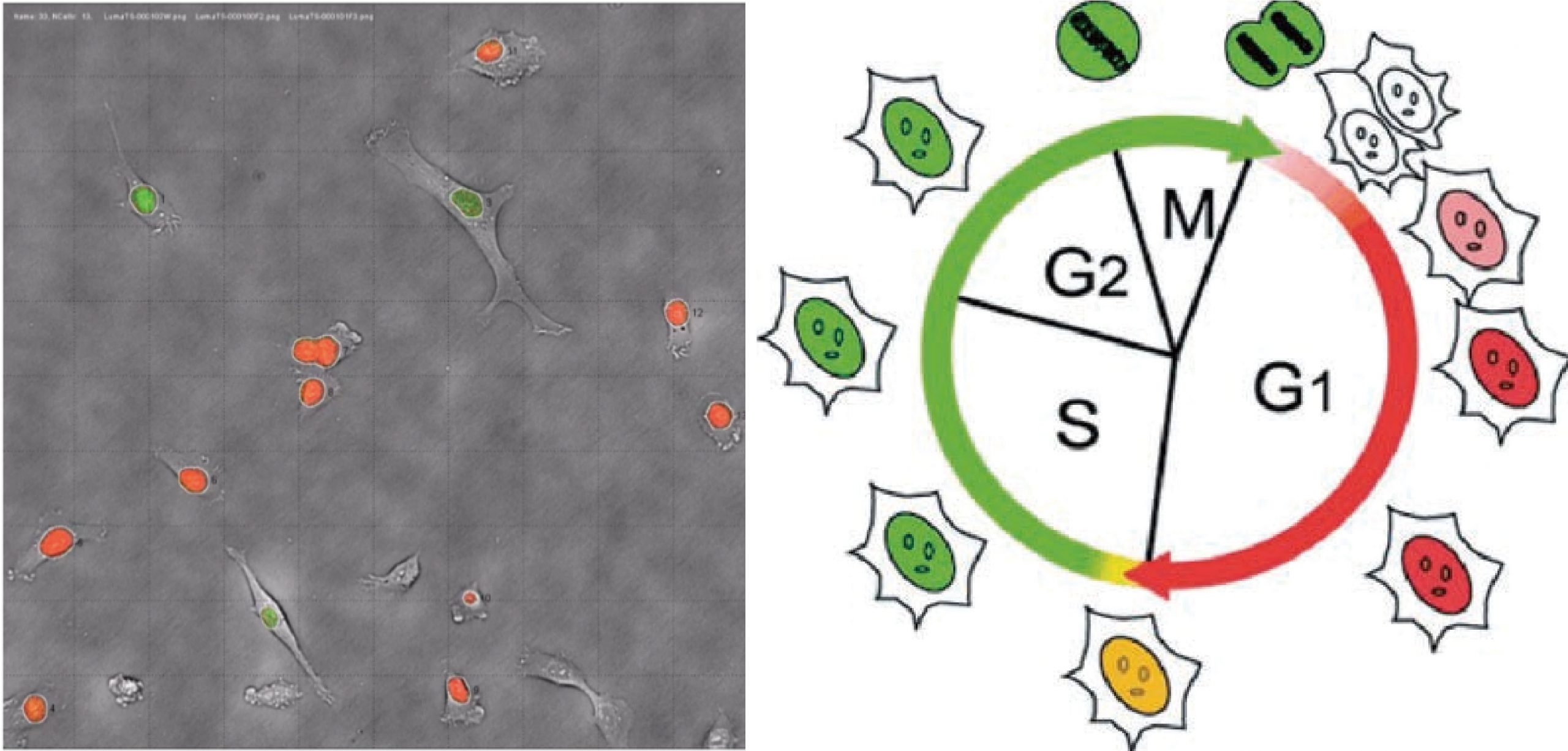
细胞周期检测
结合Premo™ FUCCI细胞周期指示剂(一种基于荧光蛋白的系统,它使用了与不同细胞周期调控因子融合的红色(RFP)和绿色(GFP)荧光蛋白:geminin和cdt1。在细胞周期的G1期,geminin被降解,细胞核内呈现红色荧光。在S、G2和M期,cdt1被降解,细胞核呈绿色荧光),以此进行活细胞周期检测;自动拍摄分裂过程关键时间节点的相差图像、荧标标记图像及细胞分裂过程影像,定量分析各周期分布中的荧光标记细胞个数。
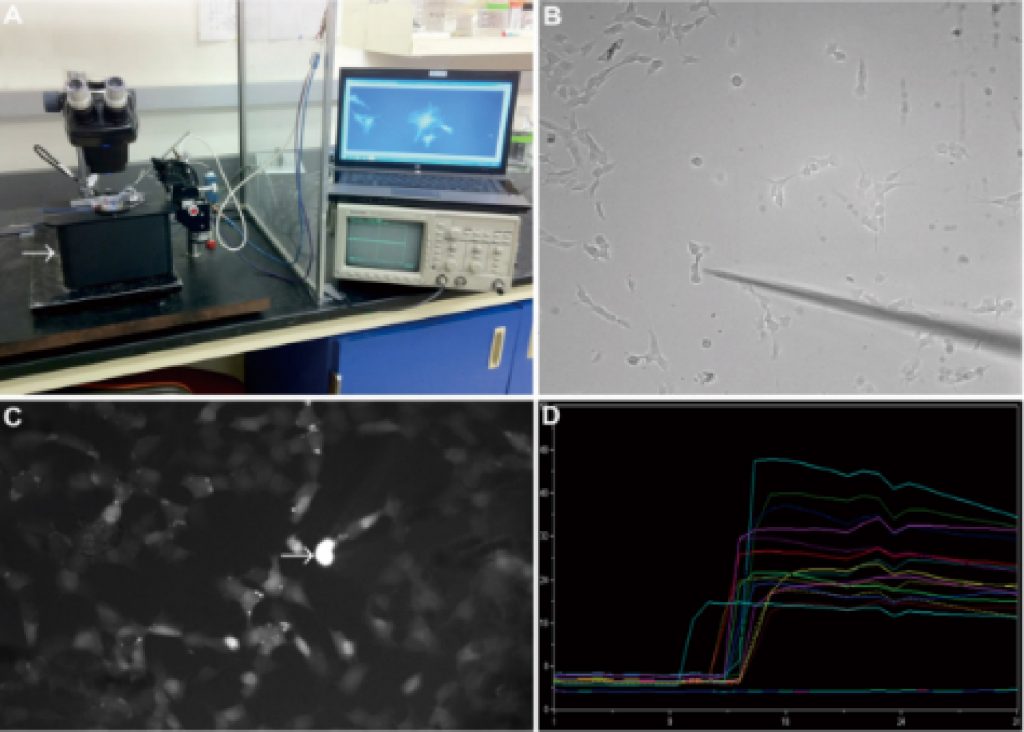
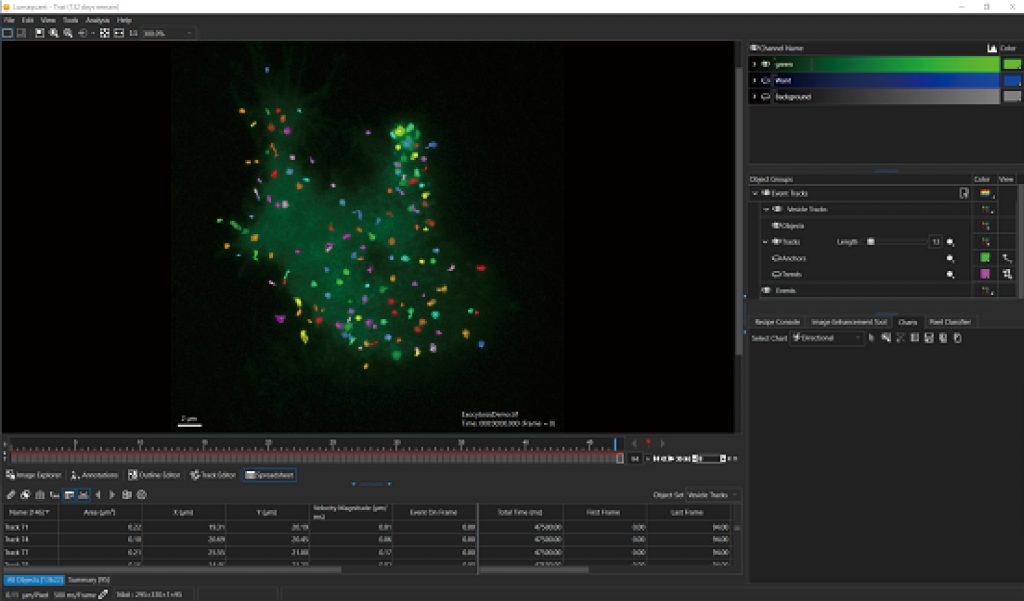
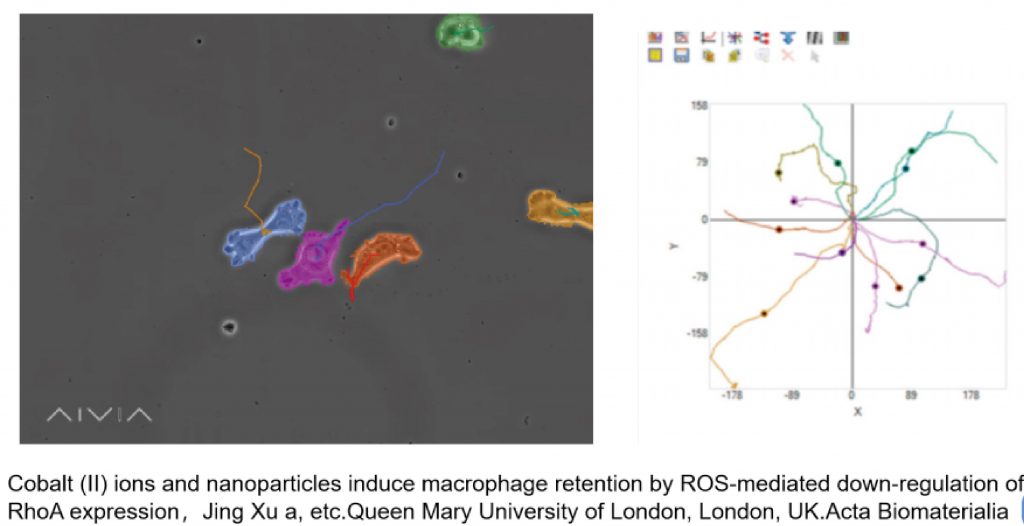
单细胞运动追踪
肿瘤迁移,细胞谱系追踪等研究中,追踪单细胞的运动特性很关键,LS720可以无标记实时追踪单细胞运动,并分析细胞运动轨迹及迁移距离,迁移速度,细胞直径,位移等定向测量数据。
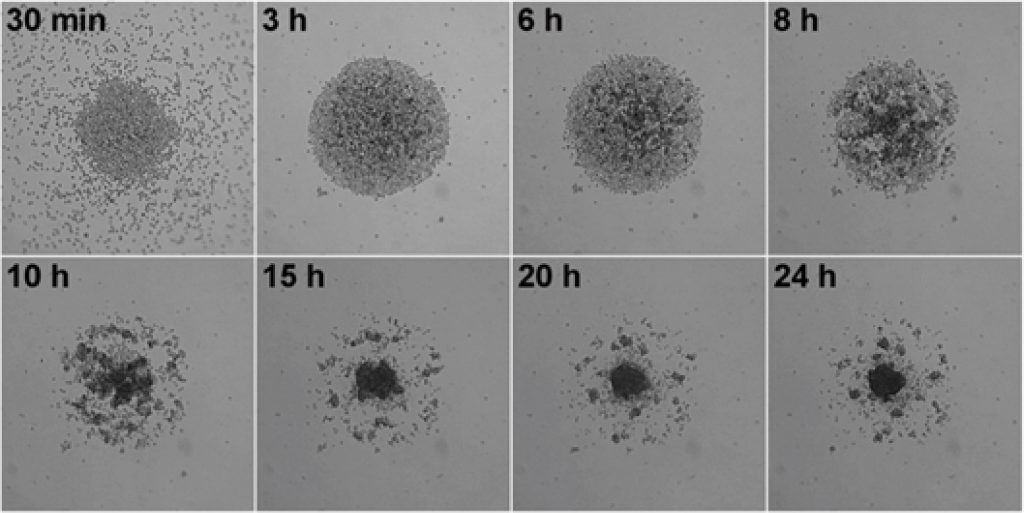
3D培养与肿瘤微环境
肿瘤微环境(tumor microenvironment ,TME),为肿瘤细胞生存场所,是一个动态复杂的网络。实体瘤的环境中包含:肿瘤细胞、肿瘤周围和内部聚集的大量免疫细胞、肿瘤血管、内皮细胞、成纤维细胞、细胞外基质和间质组织等,这些都是影响肿瘤转移的关键因素。研究发现,肿瘤微环境中的多细胞组成,往往会决定对某种特定疗法的影响,进而决定癌症治疗的成败。3D培养体系已成为体外研究复杂系统(如TME)的标准,可以通过这些体系深入了解体内发生的细胞-细胞相互作用和通信。LS720稳定的移动平台可跟踪和测量非贴壁的三维肿瘤球体的形成、生长和收缩,监控药物抑制肿瘤球体的情况:1)使用低成本的96或384孔实验方案,操作简便;2)精准定位,无需人工采集图像,减少实验重复性;3)自动定量分析球体大小,周长,面积或荧光强度等指标,量化球体健康状况。
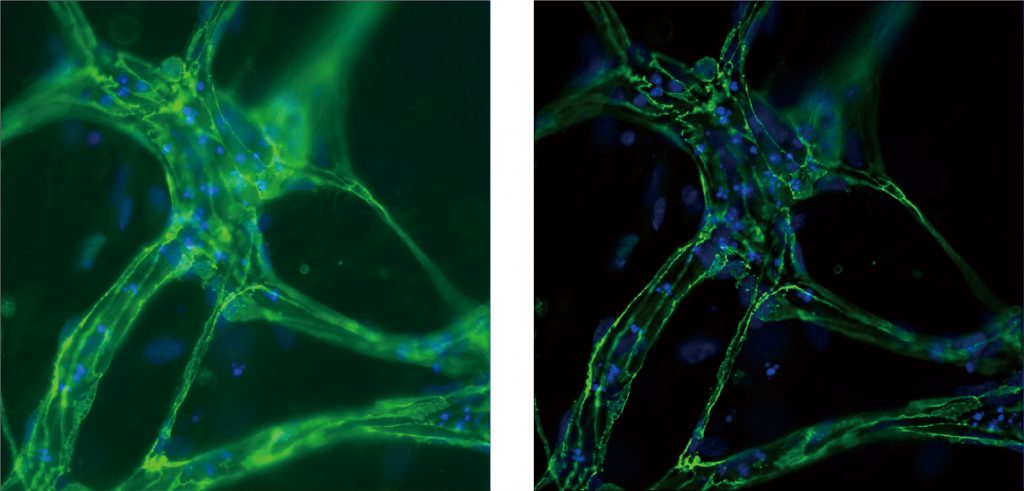
神经示踪
LS720可自动采集及定量分析原代神经细胞和多能诱导干细胞来源(iPSC-derived)的神经细胞的神经突的生长状况:1)软件自动展示并测量神经元的树突,轴突以及微管结构,2)可自动获得分支长度,分支点等神经专业分析参数;3)运用Z-stack叠层扫描,将“斜”向生长神经元(即神经元树突分支层面不在单一的拍摄层面)纵向多层拍摄,并可重叠整合成Z-max或三维重构图像,有利于分析复杂的神经元结构。

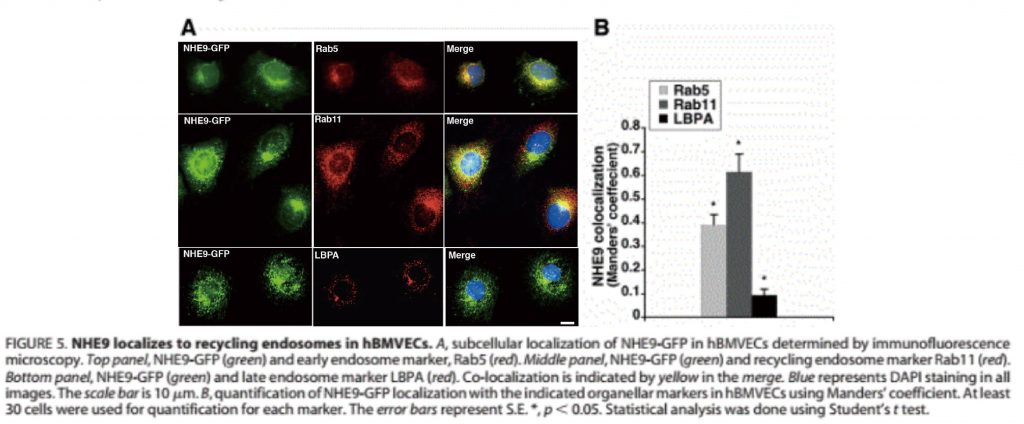
亚细胞定位
可进行血脑屏障调节机制研究,记录NHE9(氢钠交换体,一种离子转运蛋白)定位于人脑微血管内皮细胞(hBMVECs)中再循环内体(核内体的某阶段,真核细胞中的膜结合细胞器,囊泡结构)过程。
部分参考文献:
1] Del Rio B, Redruello B, et al. (2019)The biogenic amines putrescine and cadaverine show in vitro cytotoxicity at concentrations that can be found in foods,Sci Rep.
2] Jordi Gonzalez-Molina, et al. (2018) Extracellular fluid viscosity enhances liver cancer cell mechanosensing and migration. Biomaterials.
3] Bajor M, Zych AO, et al. (2018)Targeting peroxiredoxin 1 impairs growth of breast cancer cells and potently sensitises these cells to prooxidant agents. Br J Cancer.
4] Jo YJ, Lee IW, et al.( 2018 ) Spire localization via zinc finger–containing domain is crucial for the asymmetric division of mouse oocyte.FASEB J.
5] Lee CJ, Sung PL, Kuo MH, et al.( 2018 )Crosstalk between SOX2 and cytokine signaling in endometrial carcinoma.Sci Rep.
6] Beatrizdel Rio, Begoña Redruello, et al.( 2018 )Spermine and spermidine are cytotoxic towards intestinal cell cultures, but are they a health hazard at concentrations found in foods.
7] Tamaskovic R, Schwill M, et al. (2016) Intermolecular biparatopic trapping of ErbB2 prevents compensatory activation of PI3K/AKT via RAS-p110 crosstalk. Nature Communications.
8] Lee HS, Seok H, et al.( 2015) Abasic pivot substitution harnesses target specificity of RNA interference.Nature Communications.
9] Reid JA, Mollica PA,et al. (2016)Accessible bioprinting: adaptation of a low-cost 3D-printer for precise cell placement and stem cell differentiation.Biofabrication.
10] Xu J, Yang J, et al.( 2018) Cobalt (II) ions and nanoparticles induce macrophage retention by ROS-mediated down-regulation of RhoA expression.
11] Miotto M, Gouveia R, et al.( 2017)Developing a Continuous Bioprocessing Approach to Stromal Cell Manufacture. ACS Appl Mater Interfaces.
12] Lee IW, Jo YJ, et al.( 2017)Distinct roles of Cep192 and Cep152 in acentriolar MTOCs and spindle formation during mouse oocyte maturation. FASEB J.
13] Beydoun R, Hamood MA, et al.( 2017)Na+/H+ Exchanger 9 Regulates Iron Mobilization at the Blood-Brain Barrier in Response to Iron Starvation. J Biol Chem.
14] Jones AR, Edwards DH,et al. (2016) A Systemized Approach to Investigate Ca2+ Synchronization in Clusters of Human Induced Pluripotent Stem-Cell Derived Cardiomyocytes. Front Cell Dev Biol.
15] Yang J, Selvaganapathy PR, et al. (2015)A microfluidic device for rapid quantification of cell-free DNA in patients with severe sepsis.Lab Chip.
16] Ghaemi R, Rezai P,et al. (2015)Microfluidic devices for imaging neurological response of Drosophila melanogaster larva to auditory stimulus.,Lab Chip.
17] Olivier Gravel, et al. (2015)Inception of vortical coherent structures from spinning magnetic nanoparticles in rotating magnetic fields – New nanofluid microscale mixing tool.Chem. Eng. J.
18] Ricardo M., et al. (2013)Bioactive films produced from self-assembling peptide amphiphiles as versatile substrates for tuning cell adhesion and tissue architecture in serum-free conditions. J. Mater. Chem.

